Verbesserter biologischer Baukasten dank synthetischen Protozellen
Forschenden ist es gelungen, molekulare Schaltkreise in künstliche Membranen zu verpacken. Damit wird es für synthetische Biologen wohl zukünftig einfacher, komplexe Funktionen zu entwerfen.
Die synthetische Biologie erlaubt es, genetische Schaltkreise zu entwerfen. In Zellen eingebaut, ermöglichen diese neue Funktionen - etwa die Herstellung von Medikamenten und anderen wertvollen Molekülen. Eine grosse Schwierigkeit gibt es dabei allerdings: Werden die Schaltkreise komplexer, können die verschiedenen genetischen Komponente einander behindern. Komplizierte Funktionen werden so manchmal verunmöglicht.
Forschende am MIT haben nun gezeigt, dass Schaltkreise in einzelnen synthetischen Protozellen eingeschlossen und so voneinander isoliert werden können. Dies verhindert, dass sie einander in die Quere kommen. Indem die Forschenden die Kommunikationen zwischen diesen einzelnen Protozellen kontrollieren, können sie die Schaltkreise oder deren Produkte gezielt kombinieren.
„Wir haben nun die Möglichkeit, genetische Kaskaden mit vielen Komponenten zu haben und Wände zwischen diesen zu errichten. So können wir verhindern, dass es zu unerwünschten Wechselwirkungen kommt. Dies wäre nämlich der Fall, wenn wir alle Komponenten in einer einzelnen Zelle oder in einem Becherglas zusammenfügen würden“, sagt Edward Boyden, Professor am MIT. Dieser Ansatz könnte es anderen Forschenden zum Beispiel erlauben, Schaltkreise zu entwerfen, die komplexe Produkte herstellen oder als Sensoren funktionieren, die auf Umweltveränderungen reagieren.
Verbesserte Kontrolle
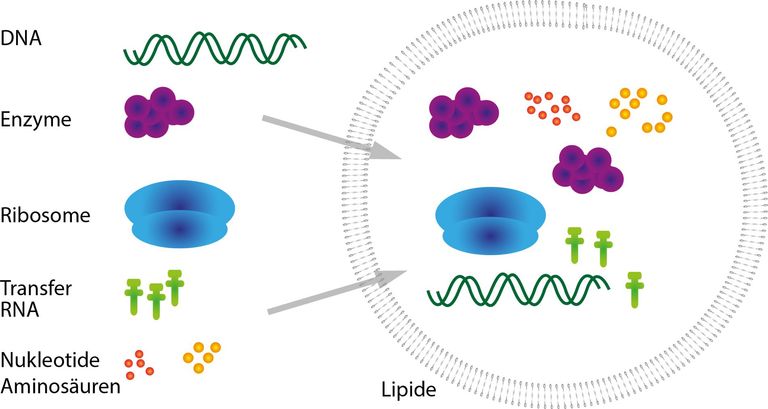
Die MIT-Forschungsgruppe hat ihre genetischen Schaltkreise in sogenannte Liposome verpackt. Liposome sind Bläschen mit einer fetthaltigen Membran, ähnlich der Zellmembran. Diese synthetischen Protozellen sind keine Lebewesen. Sie besitzen aber einen grossen Teil der Zellmechanismen, die für das Ablesen von DNA und die Herstellung von Eiweissen notwendig.
Indem die einzelnen Schaltkreise in jeweils ein eigenes Liposom verpackt werden, können Unterfunktionen entworfen werden, welche parallel zueinander laufen und in kontrollierter Weise miteinander kommunizieren. Dies wäre nicht möglich, wenn alle diese Unterfunktionen im selben Gefäss aktiv wären. Dieser Ansatz hat aber noch einen weiteren Vorteil: die selben genetischen Werkzeuge können für verschiedene Zwecke im selben Netzwerk genutzt werden. Als genetische Werkzeuge gelten z.B. Transkriptionsfaktoren, die Gene aus- oder einschalten. „Wir isolieren zwei Schaltkreise in zwei verschiedenen Liposomen voneinander. So kann ein genetisches Element im ersten Liposom eine bestimmte Aufgabe übernehmen und im zweiten Liposom eine andere Aufgabe“, beschreibt Daniel Martin-Alarcon, Doktorand am MIT und massgeblich an der Forschungsarbeit beteiligt. “Dies vergrössert die Anzahl Möglichkeiten, die wir für einen einzelnen Baustein haben“.
Hybrid-System aus verschiedenen Organismen
Der Ansatz ermöglicht es auch, dass Schaltkreise aus unterschiedlichen Organismen wie z.B. einem Bakterium und einem Säugetier, miteinander kommunizieren. Um dies zu zeigen, stellten die Forschenden ein erstes Liposom mit einem Schaltkreis aus bakteriellen genetischen Elemente her. Dieser Schaltkreis erkennt das Molekül Theophyllin – ein Wirkstoff ähnlich dem Koffein. Ist Theophyllin präsent, wird ein anderes Molekül mit dem Namen Doxycycline aus dem Liposom freigesetzt. Das Doxycycline verbindet sich anschliessend mit einem zweiten Liposom, welches einen Schaltkreis aus einem Säugetier enthält. Darin aktiviert das Doxycycline eine weitere genetische Kaskade, die den Leuchtstoff Luciferin produziert. In einem weiteren Schritt ist den Forschenden auch gelungen, mit ihrem Ansatz biologische Therapeutika zu produzieren. Setzte beispielsweise eine Hirnzelle ein bestimmtes Molekül frei, produzierten die Liposomen einen Antikörper.
„Man kann sich den Schaltkreis aus dem Bakterium als eine Art Computer-Programm vorstellen und den Schaltkreis aus dem Säugetier als eine Art Fabrik. Es ist nun möglich, den Computer-Code und die Fabrik zu einem einzigartigen Hybridsystem zu kombinieren“, sagt Boyden.
Die Forschenden haben auch Liposome entwickelt, die miteinander in einer kontrollierten Art und Weise fusionieren. Um dies zu erreichen, haben sie Zellen mit sogenannten SNARE-Eiweissen ausgestattet. Diese SNAREs befinden sich in der Zellmembran und haben die Eigenschaft, entsprechenden SNAREs auf anderen Liposomen zu binden. Dabei werden die Liposome funsioniert. Der Zeitpunkt dieser Fusion kann kontrolliert werden. Liposome, welche unterschiedliche Moleküle produzieren, können so zur gewünschten Zeit zusammengebracht werden, damit sich die Moleküle kombinieren und ein Endprodukt hergestellt wird.
Ein verbessertes Baukastenprinzip
Die Forschenden glauben, dass ihr Ansatz für nahezu alle Anwendungen der synthetischen Biologie von Nutzen sein kann. Viele Arbeiten für nützliche Anwendungen wurden in der Vergangenheit aufgegeben, weil die genetischen Schaltkreise einander zu stark behinderten. Mit diesem neuen Ansatz könnten diese wieder neu aufgenommen werden
„Wir haben mit unserer Arbeit nicht auf eine einzelne Anwendung abgezielt“, erklärt Boyden. „Die grundlegende Frage ist: Können wir die Schaltkreise baukastenartiger machen? Wenn man alles in einer Zelle, sind die Schaltkreise oft nicht kompatibel oder sogar schädlich für die Zelle. Wenn wir nun diese Reaktionen mit Wänden voneinander trennen und es ihnen ermöglichen, gezielt miteinander zu kommunizieren, könnte dies sehr nützlich sein“.
Vincent Noireaux, Professor an der University of Minnesota, beschreibt den Ansatz des MIT als „eine ziemlich neuartige Methode um zu lernen, wie biologische Systeme funktionieren“. Noireaux, der selber nicht an der Forschungsarbeit beteiligt war, führt aus: „Es hat mehrere Vorteile, wenn genetische Schaltkreise wie hier ausserhalb von lebendigen Zellen genutzt werden: Technisch wird die Arbeit einfacher. Wir können die Informationsverarbeitung mit biologischen Funktionen verlinken, wie es lebende Zellen tun. Und wir arbeiten isoliert, also ohne andere Gene, die im Hintergrund aktiv sind.“
Der Ansatz könnte auch zu Erkenntnissen beitragen, wie sich die ersten Zellen vor Milliarden Jahren entwickelt haben. Mit einfachen Schaltkreisen in Liposomen liesse sich untersuchen, wie Zellen verschiedene Fähigkeiten entwickeln haben: ihre Umwelt wahr zu nehmen, auf Reize zu reagieren und sich fortzupflanzen. „Dieses System kann als Model für das Verhalten und die Eigenschaften der frühesten Organismen der Erde dienen. Es kann auch dazu beitragen, die physischen Grenzen eines Erden-typischen Lebewesens zu definieren. Darauf aufbauend können wir anderswo im Sonnensystem und darüber hinaus nach Leben suchen“,sagt die Postdoc Kate Adamala, die massgeblich am Projekt beteiligt war.
Quelle: übersetzt und angepasst von der Medienmitteilung des MIT.
